タンパク質の一生と
細胞がミトコンドリアをつくる仕組み
1.はじめに
地球上の生物はすべて細胞という基本単位からできています。細胞の中には分子,分子複合体,オルガネラ,細胞,個体・・と秩序のある階層構造がつくられています。個々の要素が集まり,高次の構造を形成すると,そこに個々の要素だけでは実現できなかった新たな機能が生まれます。生命現象はこうした階層化された構造と深く結びついています。それではこうした生命現象の根源というべき細胞の構造はどのように作られるのでしょうか。
生命の設計図であるDNAの情報に基づいてタンパク質をつくり,核酸や脂質など,細胞を構成する成分をバラバラに試験管に放り込んでも,生命は生まれません。DNAに書き込まれた設計図に基づいて,「自己集合の原理」で分子から細胞を組み立てようとしても,どこかの階層でこの原理は破綻するのです。すなわちDNAに書き込まれた情報だけでは,細胞の部品とその単純な集合体をつくることはできても,細胞の複雑な構造はつくれません。細胞の構造は既存の細胞を拡大し,複製することでしかつくることができないのです。
地球上のすべての生物の細胞は,40億年の進化の過程で生命誕生時を除けば,ゼロから新たにつくられたことは一度もなく,既存の細胞の複製によってのみ,受け継がれてきました。したがって生命の設計図は,DNAに書き込まれた部品作成のための情報と,既存の細胞構造に書き込まれた鋳型情報の2種類のブループリントを必要とすることになります。生物のゲノム情報については著しく解明が進みましたが,細胞構造に書き込まれた設計情報については,まだ多くが未解明です。細胞構造構築原理の解明と,それに基づいて細胞をつくりだすこと,これは生命科学の最終目標の1つと言えるでしょう。
2. ミトコンドリアとは
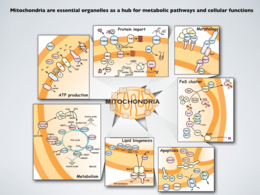
細胞内構造の研究対象として,私たちが精力的に研究を進めてきたのがミトコンドリアです。ミトコンドリアは細胞内の発電所にたとえられるように,生命活動に必須のエネルギーを酸化的リン酸化によって作り出すオルガネラ(小器官)です。それだけでありません。酵母のように呼吸だけでなく発酵で生きられる生物においても,ミトコンドリアは必須です。このことはミトコンドリアが呼吸(酸化的リン酸化)以外にも,細胞機能に必須の働きをしていることを意味しています。ミトコンドリアがないように見える真核生物であっても,ミトコンドリア機能の痕跡はいまだに残っています。ミトコンドリアは,クエン酸回路や脂肪酸のβ酸化などの重要な代謝経路を擁し,アミノ酸,脂質,ステロイド,ヘムなど様々な物質の合成を担い,プログラム化された細胞死アポトーシスにおいても中心的役割を担っています。特に鉄イオウクラスターの合成は,呼吸以外の細胞の必須機能と結びついているのではないか,と言われています。ミトコンドリアが健康であることはヒトの健康につながり,その機能低下が神経変性疾患やがん,糖尿病,老化などと関係することもわかってきています。
ミトコンドリアは外膜と内膜の2枚の生体膜で囲まれています。外膜と内膜の間には膜間部,内膜の内側にはマトリックスと呼ばれる水溶性区画がつくられ,内膜はミトコンドリア機能に応じて内側に拡大陥入し,クリステと呼ばれる独特の構造をつくります(クリステ以外の部分は境界膜と呼びます)。ミトコンドリアが正常に機能するためには,ミトコンドリアを構成する800(酵母)〜1500(ヒト)種類のタンパク質と,カルジオリピンを含む固有の脂質組成が必要です。ミトコンドリアは細胞から単離しても,しばらくは酸化的リン酸化やタンパク質合成などの機能を維持していますが,やがて機能を失っていきます。それでは細胞内ではミトコンドリアはどのように作られ,機能が維持されているのでしょうか。細胞内では,ミトコンドリアは多くの場合ヒモ状で枝分かれした構造をもち,絶えず分裂と融合を繰り返すダイナミックな構造体です。細胞がミトコンドリア機能を必要とするときは,ミトコンドリアは拡大・増殖し,細胞が分裂するときは,娘細胞に正確に分配されます。神経細胞のように大きな細胞では,ミトコンドリアは細胞骨格を使ってダイナミックに移動し,細胞の隅々にまでエネルギーを提供します。一方でミトコンドリア機能は常に監視され,ミトコンドリア機能が低下すると,その部分をちぎって,分解処理する仕組み(ミトコンドリアの品質管理)も見つかってきています。
3. ミトコンドリアとタンパク質動態
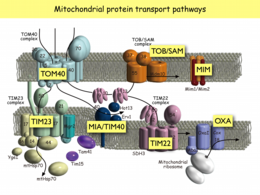
当研究室では,主として出芽酵母を使って,タンパク質の交通と脂質の交通,そしてミトコンドリア構造のダイナミクスという観点から,ミトコンドリアがつくられ,その機能が維持される仕組みを研究しています。ミトコンドリアは,もともと好気性細菌が細胞内共生してできたオルガネラですが,今日ではミトコンドリア内のゲノムは10種前後のタンパク質をコードするに過ぎず,99%以上のタンパク質は核ゲノムにコードされています。それらのタンパク質はサイトゾルで合成されてから,あるいは合成されつつミトコンドリア内に取り込まれ,ミトコンドリア内の特定区画(外膜,膜間部,内膜,マトリックス)に仕分けられます。こうしたミトコンドリアタンパク質の交通管制の仕組みについては,当研究室を含むいくつかのグループによって,この20年くらいの間に多くのことが分かってきました。ミトコンドリアタンパク質の交通管制を担うのは,外膜と内膜にある分子機械,トランスロケータ(トランスロコン)です。
外膜にはTOM40複合体,TOB/SAM複合体,内膜にはTIM23複合体,TIM22複合体などのトランスロケータがあります。ほとんどのミトコンドリアタンパク質は,まず外膜のTOM40複合体によってミトコンドリア行きシグナルをチェックされ,βバレル型膜タンパク質Tom40がつくる膜透過チャネルを使って,ミトコンドリア内に取り込まれます。その後,目的区画別に各トランスロケータによる仕分けが行われます。たとえば外膜のβバレル型膜タンパク質は,膜間部にいったん移行した後, TOB/SAM複合体を使ってβバレル構造をつくりながら外膜に組み込まれます。ミトコンドリア行きシグナルをN末端の「プレ配列」にもつタイプのミトコンドリアタンパク質は,TIM23複合体を使ってマトリックスや内膜に仕分けられます。TIM23複合体はαヘリックスから成る膜透過チャネルをもち,このチャネルを通過するためには内膜の膜電位や,マトリックスのHsp70によるATP加水分解のエネルギーを必要とします。ADP/ATPキャリアやリン酸キャリアなど,プレ配列を持たない複数回膜貫通内膜タンパク質は,TIM22複合体を使って内膜に組み込まれます。このとき内膜の膜電位が必要となります。外膜にはTOM40複合体,TOB/SAM複合体,内膜にはTIM23複合体,TIM22複合体などのトランスロケータがあります。ほとんどのミトコンドリアタンパク質は,まず外膜のTOM40複合体によってミトコンドリア行きシグナルをチェックされ,βバレル型膜タンパク質Tom40がつくる膜透過チャネルを使って,ミトコンドリア内に取り込まれます。その後,目的区画別に各トランスロケータによる仕分けが行われます。たとえば外膜のβバレル型膜タンパク質は,膜間部にいったん移行した後, TOB/SAM複合体を使ってβバレル構造をつくりながら外膜に組み込まれます。ミトコンドリア行きシグナルをN末端の「プレ配列」にもつタイプのミトコンドリアタンパク質は,TIM23複合体を使ってマトリックスや内膜に仕分けられます。TIM23複合体はαヘリックスから成る膜透過チャネルをもち,このチャネルを通過するためには内膜の膜電位や,マトリックスのHsp70によるATP加水分解のエネルギーを必要とします。ADP/ATPキャリアやリン酸キャリアなど,プレ配列を持たない複数回膜貫通内膜タンパク質は,TIM22複合体を使って内膜に組み込まれます。このとき内膜の膜電位が必要となります。
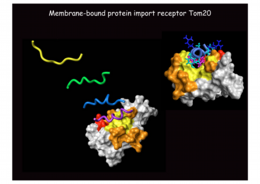
私たちは,2000年に神田大輔グループ(九大)との共同研究で,ミトコンドリア行きシグナル受容体Tom20の構造を決定しました。Tom20は膜結合型行き先シグナル受容体としては世界で最初の構造であったことから,多くの教科書にその構造が引用されています。その後も,膜間部でタンパク質にジスルフィド結合を導入するTim40/Mia40(細胞内でジスルフィド結合がかかるのは小胞体内腔とミトコンドリア膜間部だけです)やマトリックスのシャペロンHsp70のシャペロンTim15など,様々な因子の構造を決定しましたが,肝心のトランスロケータ複合体全体やその中心となる膜透過チャネルの精密構造はいまだに解明されていません。そのため,タンパク質の膜透過にともなうチャネルの開閉,膜透過の駆動力を与えるシャペロン等の因子との連携の仕組み,チャネルの膜方向(ラテラル)ゲートが開いて膜タンパク質が膜に組み込まれる仕組みなど,多くの問題が未解決のままです。明らかに構造生物学に基づく,トランスロケータの動作機構の解明が喫緊の課題と言えます。
4. ミトコンドリアと脂質動態
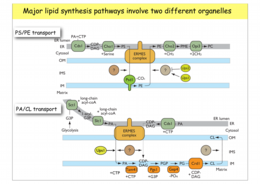
タンパク質の交通に比べて,まだほとんど分かっていないのが脂質の交通です。細胞内の各オルガネラ膜や細胞膜は各々脂質組成が異なっており,各生体膜の外側と内側でも組成が異なります。こうした各膜系固有の脂質組成は,オルガネラの機能発現に重要であると考えられています。細胞内でリン脂質合成を担う一連の酵素の多くは小胞体膜とミトコンドリア内膜に局在しています。したがって,細胞が必要とする脂質を合成するためには脂質が小胞体とミトコンドリアの間を往き来する必要があり,さらに合成された脂質は細胞内の様々な膜系に選択的に運ばれる必要があります。疎水的で水に溶けない脂質がどのように水溶性区画を越えて,膜から膜へと移動するのか,その方向性や特異性はどのように決まるのか,などの基本的な問題は,まだほとんど分かっていません。ミトコンドリアの外膜や内膜で外面と内面の間の脂質の反転輸送を担うスクランブラーゼやフリッパーゼについても,まったくわかっていません。
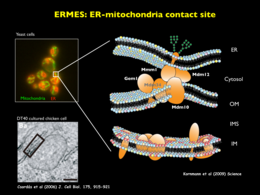
膜から膜へと脂質を運ぶ1つの方法は,専用の輸送タンパク質が1つの膜で脂質を積荷として積み込み,水溶性区画を拡散して,もう一つの膜で脂質の荷下ろしをすることです。実際,ミトコンドリアの外膜と内膜の間では,Upsタンパク質がホスファチジン酸などのリン脂質を特異的に運ぶことが分かってきました。一方,異なるオルガネラの膜間で脂質を移動させる拠点としての可能性が注目されているのがオルガネラ間テザリング(コンタクト)部位です。ER,ミトコンドリア,液胞,エンドソーム等の異なるオルガネラを物理的に接合させるテザリング部位が,いま次々に見つかりつつあります。なかでも出芽酵母のERとミトコンドリア外膜を接合させるERMESは,構成因子が同定され,その構造と機能が注目されています。脂質輸送だけでなく,ミトコンドリアの分裂や形態の制御部位としての機能,ERのカルシウムイオン貯蔵の制御など,様々な機能が考えられています。
テザリング部位について興味深いのは,どこかのオルガネラ間テザリング部位を欠失させて脂質輸送を阻害しようとしても,細胞は別のテザリング部位を使って脂質輸送を復帰させるように見えることです。脂質の交通は細胞機能の維持に必須であるため,細胞は脂質の交通について,何重にもフェイルセーフシステムを用意しているのかもしれません。タンパク質の交通についてはBlobelのシグナル仮説やSchekmanとRothmanの小胞輸送のような基本機構・基本原理が明らかになっていますが,脂質の交通については,基本機構も基本原理も,まだ明らかになっていません。また,相次ぐオルガネラ間テザリング部位の発見は,「各オルガネラは生化学反応を互いに隔離し,独立して働くことで細胞機能を分散管理する」という描像がもはや正しくないことを示しています。「各オルガネラはテザリング部位を介して,物質や情報を交換し,互いが細胞構造の一部分として構造的にも機能的にも連携して働いている」,というのが新しいオルガネラ像と言えるかもしれません。
5. 最後に
当研究室では,こうした問題の答えを得るべく,主に出芽酵母を材料として,生化学,分子生物学,細胞生物学,構造生物学,遺伝学の技術を駆使して研究を進めています。また,こうした問題を研究するための新しい方法論の開発も行っています。当研究室の研究に興味がある方,一緒に研究をしてみたい方は,ぜひご連絡ください。
〒603-8555 京都市北区上賀茂本山
京都産業大学総合生命科学部・教授
遠藤斗志也
電子メール:tendo@cc.kyoto-su.ac.jp
電話:075-705-1508